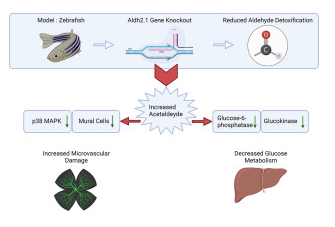
摘要:活性羰基化合物(RCS)是在新陳代謝過程中自發形成的,會改變和損害DNA、蛋白質和脂質的功能,導致多種器官并發癥。在斑馬魚中,RCS解毒酶乙二醛酶1(Glo 1)、醛脫氫酶3a1(Aldh3a1)和醛酮還原酶1a1a(Akr1a1a)的敲除顯示RCS升高,其特異性地調節葡萄糖代謝、高血糖和糖尿病器官損傷。在 glo1-/- 動物中aldh2.1 是補償性上調的,因此本研究旨在研究與乙醇暴露無關情況下, Aldh2.1 在斑馬魚中對 RCS 的解毒能力。使用 CRISPR/Cas9 生成 aldh2.1 敲除斑馬魚,隨后在組織學、代謝組學和轉錄組學水平上進行分析。 aldh2.1-/- 斑馬魚顯示內源性乙醛 (AA)增加 ,誘導視網膜脈管系統血管生成增加。表達和藥理學介入研究確定了由 AA 誘導的 c-Jun N-末端激酶 (JNK) 和 p38 MAPK 的失衡,其介導了血管生成的激活。此外,aldh2.1-/- 斑馬魚中 AA 的增加不會引起高血糖,相反,AA 會抑制葡萄糖激酶 (gck) 和葡萄糖-6-磷酸酶 (g6pc) 的表達,從而導致葡萄糖代謝受損。
關鍵詞:醛脫氫酶 (ALDH) 乙醛(AA) 活性羰基物質 (RCS) 葡萄糖代謝 微血管器官并發癥 斑馬魚
簡介:活性羰基物質 (RCS) 是一類代謝物,與葡萄糖代謝受損、胰島素抵抗和微血管損傷有關。甲基乙二醛(MG)是研究得最好的代表,其作為晚期糖基化終產物(AGEs)前體的毒性而聞名。由 glo1 和 glo 2 組成的乙二醛酶 (Glo) 酶系統利用了 MG 的解毒作用。然而,最近在斑馬魚和小鼠中的研究表明,敲除 glo1 僅導致內源性 MG 增加 50%。因此,glo1基因敲除斑馬魚雖然表現出糖耐量受損,但并沒有出現器官損傷,只有在攝入高熱量后,它們的視網膜血管系統才會發生改變,這與臨床糖尿病視網膜病變的病理結果一致。這些結果表明,體內glo1 MG 解毒能力的喪失可以通過其他酶系統得到補償。 事實上,glo1 突變體中醛脫氫酶 (Aldh) 和醛酮還原酶 (Akr) 的活性測量表明這兩個酶家族可以作為 MG 的替代解毒系統。隨后對斑馬魚中不同 Aldh 和 Akr 亞類成員的研究,包括 aldh3a1 和 akr1a1a 斑馬魚突變體的產生和分析,發現不是 MG,而是 Aldh3a1 的 4-羥基壬烯醛 (4-HNE) 和 Akr1a1a 的丙烯醛 (ACR) 是首選的解毒 RCS。雖然兩種突變體的葡萄糖代謝均受損,但 aldh3a1 突變體中 4-HNE 增加會破壞胰腺,導致高血糖和視網膜血管改變,而 akr1a1a 突變體中 ACR 增加會導致胰島素抵抗和成年動物糖尿病視網膜病變和糖尿病腎病。數據已經確定了 RCS 及其相應解毒酶在調節葡萄糖代謝方面的特定特征,這些系統的改變導致葡萄糖耐量受損、胰島素抵抗、高血糖和微血管并發癥。
glo1-/- 斑馬魚突變體中的 aldh2.1 表達也有所增加。 aldh2.1 是斑馬魚與人類 aldh2 的同源物,可以解毒多種反應性代謝物,包括乙醛 (AA)、4-HNE、丙二醛 (MDA) 和 MG。由于 Aldh2 將 AA 氧化為乙酸,因此對其在酒精代謝和酒精引起的應激并發癥中的重要性進行了充分研究,發現在酒精性肝病和心血管疾病中起關鍵作用。此外,aldh2 的缺失會增加活性氧 (ROS),從而導致線粒體功能障礙和細胞色素 P450 2E1 (CYP2E1) 的上調。然而,Aldh2對反應性代謝物解毒、糖代謝調節和糖尿病微血管并發癥形成的貢獻,是否與乙醇暴露無關,目前尚不清楚。因此,本研究旨在評估 Aldh2.1 對斑馬魚不同 RCS 的解毒能力,并確定 Aldh2.1 對葡萄糖代謝、器官生理和疾病的潛在調節功能。我們的數據確定,斑馬魚中 aldh2.1 的缺失導致內源性 AA 濃度增加,隨后損害了斑馬魚仔魚和成魚的葡萄糖代謝并導致視網膜血管微血管損傷。
aldh2.1-/- 基因敲除斑馬魚的生成和驗證:最近對脊椎動物和哺乳動物的研究表明,Aldh酶在解毒短鏈和長鏈RCS中起主要作用。為了研究 Aldh2.1 對 RCS 解毒和葡萄糖代謝調節的影響,我們創建了一個 aldh2.1 基因敲除斑馬魚模型,因為之前的研究表明 aldh2.1 在反應性代謝物解毒中具有補償功能。Aldh2.1 酶在人類、小鼠和斑馬魚中表達。 然而,尚未描述不同物種之間酶氨基酸序列的相似性。因此,該研究的第一步是對斑馬魚和人類、斑馬魚和小鼠之間的氨基酸序列進行比對,發現斑馬魚和人類之間的相似性達到78.2%,斑馬魚和小鼠之間的相似性達到77.4%。整個物種的活性位點中的半胱氨酸和谷氨酸氨基酸被完全保留并在每個物種中保持不變。迄今為止,還沒有產生 aldh2.1-/- 斑馬魚品系,因此利用 CRISPR/Cas9 技術創建了 aldh2.1 基因敲除模型。首先,合成靶向 aldh2.1 外顯子 3 的 CRISPR-guideRNA (gRNA),并與 Cas9 mRNA 一起注射到單細胞期 Tg(fli1:EGPF) 斑馬魚胚胎中。 由于五個核苷酸的缺失,測序發現了一個由于五個核苷酸缺失而導致的閱讀移碼突變,然后將其用于進一步的育種和研究。為了驗證純合 aldh2.1-/- 突變體的產生,進行了蛋白質印跡并顯示肝臟中的 Aldh2.1 蛋白完全喪失。與 aldh2.1+/+ 仔魚相比,受精后 5 天 (dpf) 的 aldh2.1-/- 仔魚的總體形態沒有改變。在少數 aldh2.1-/- 胚胎/仔魚中,肝臟似乎變大。 有趣的是,成年 aldh2.1-/- 動物的存活率偏離了估計的孟德爾分布,并且顯著低于預期。在 282 條成年斑馬魚中,99 條(35.1%)為 aldh2.1+/+,122 條(43.2%)為 aldh2.1+/-,只有 61 條(21.7%)有 Δ5 bp 型的 aldh2.1-/-, 這些結果表明,Aldh2.1 的永久丟失會對斑馬魚產生負面影響。由于 aldh2.1 在成年斑馬魚中的表達是未知的,因此使用 RT-qPCR 分析來研究 aldh2.1 在整個斑馬魚器官中的表達。與持家基因 b2m 的表達相比,我們發現 aldh2.1 在肝臟 (15%) 中的表達最高,其次是大腦 (6.8%) 和眼睛 (5%)。總體而言,這些結果證實了 aldh2.1 在斑馬魚器官中的表達與其他脊椎動物相當。 接下來,使用不同的 RCS 作為底物進行了一組 Aldh 酶活性測量,以確認 aldh2.1 敲除導致總 Aldh 酶活性的功能性降低。使用以下底物可以觀察到 aldh2.1-/- 仔魚裂解物中總 Aldh 酶活性顯著降低:AA (67%)、MG (31%)、4-HNE (23%) 和 MDA (16%) )。以ACR(圖1K)為底物的Aldh總酶活性也降低了28%,但不顯著。這些結果不僅進一步證明了 aldh2.1-/- 突變體的成功產生,而且還確定了 Aldh2.1 酶在斑馬魚中對RCS 的解毒能力。

圖 1. aldh2.1-/- 斑馬魚系的生成和驗證。
aldh2.1 的缺失導致斑馬魚仔魚和成魚視網膜血管系統的血管生成:在之前的研究中,可以發現斑馬魚眼睛中的外源性和內源性反應性代謝產物通過受損的葡萄糖代謝損害微血管。為了研究 aldh2.1 敲除對血管發育的潛在后果,我們通過共聚焦顯微鏡分析了仔魚和成年斑馬魚的脈管系統。 與 5 dpf 的 aldh2.1+/+ 仔魚相比,可以確定 aldh2.1-/- 斑馬魚仔魚的玻璃體血管系統中的分支點增加。12 mpf 時成魚視網膜血管系統的量化證實了這些結果。與 aldh2.1+/+ 成魚相比,aldh2.1-/- 成魚的視網膜血管高密度區域的分支點也增加了。此外,使用胰蛋白酶和隨后的 Mayer 蘇木精染色制備成魚視網膜的消化物顯示血管壁細胞覆蓋率損失 10%,而 aldh2.1-/- 斑馬魚血管中的內皮細胞數量沒有變化。此外,成年 aldh2.1-/- 斑馬魚的血管比 aldh2.1+/+ 斑馬魚的血管更寬,隨后每條血管的毛細血管面積增加了 10%。除了眼睛,還分析了斑馬魚的腎臟。 相反,PAS染色和電子顯微鏡都沒有發現明顯的變化。這些結果表明,Aldh2.1 的功能喪失導致血管系統的改變,與患有視網膜病變的患者相似。由于鮮有報道稱活性代謝物與視網膜損傷之間存在關聯,因此對仔魚和成年斑馬魚中的幾種活性代謝物進行了測量。

圖 2. aldh2.1 的缺失導致斑馬魚仔魚和成魚視網膜血管系統中的血管生成增加。

圖 3. aldh2.1-/- 視網膜中血管增厚和血管壁細胞覆蓋率降低。
aldh2.1-/- 突變體顯示內源性 AA 升高和餐后血糖降低:
之前關于Aldh3a1酶引起的糖尿病器官并發癥的研究表明,RCS解毒功能受損是視網膜新生血管增加的原因。然而,aldh2.1-/- 突變體的解毒活性受損是否會轉化為類似的內源性反應性代謝物升高或葡萄糖代謝受損仍然未知。我們對96 hpf齡仔魚和成年斑馬魚器官中的葡萄糖和活性代謝物進行了一系列測量。在仔魚體內,未發現全身葡萄糖、鎂、乙二醛、4-HNE和ACR的變化。我們可以確定反應性代謝物 AA 的升高,與 aldh2.1+/+ 相比,aldh2.1-/- 仔魚的 AA升高 4.2 倍,但代謝組的AA保持不變。在成年斑馬魚中,禁食 aldh2.1?/? 斑馬魚肝臟中的 AA 濃度增加了 4.3 倍。然而,空腹和餐后 MG 沒有變化。有趣的是,雖然 aldh2.1-/- 成魚的空腹血糖水平沒有變化,但餐后測量顯示血糖水平降低。總之,數據已確定 AA 是斑馬魚中 Aldh2.1 解毒活性的主要 RCS。 盡管 aldh2.1 敲除對廣泛的 RCS 的總 Aldh 酶活性有影響,但只有 AA 在體內積累。

圖 4. aldh2.1-/- 突變體顯示內源性 AA 升高和餐后血糖降低。
aldh2.1-/- 突變體表現出應激信號加重和糖酵解障礙:為了研究導致 aldh2.1-/- 突變體血管改變的潛在機制并解決為什么 aldh2.1-/- 突變體會導致餐后血糖降低,我們在斑馬魚仔魚中進行了 RNA 測序分析。Kyoto-encyclopedia基因和KEGG通路分析揭示了幾種受 aldh2.1 敲除顯著調控的通路,包括但不限于上調的應激信號和下調的能量代謝。細胞凋亡、鐵死亡和細胞衰老的標準化富集評分 (NES) 介于 1.5 和 1.7 之間。更重要的是,發現了 NES 為 1.46 的 VEGF 通路成分和 NES 為 1.58 的絲裂原活化蛋白激酶 (MAPK) 的過表達,為 aldh2.1-/- 視網膜血管中的機制提供了第一個線索。在另一個位點,下調的能量代謝途徑包括脂肪酸降解和氨基酸代謝,但也發現了丙酮酸代謝和糖酵解/糖異生。糖酵解/糖異生的基因集富集分析 (GSEA) 顯示丙酮酸代謝的 NES 分別為 -1.82 和 -2.02,表明 aldh2.1 確實參與了葡萄糖代謝。

圖 5. aldh2.1-/- 突變體表現出加強的應激信號傳導以及糖酵解和糖異生的損害。
aldh2.1-/- 突變體中葡萄糖-6-磷酸酶表達的抑制和 JNK 和 p38 MAPK 表達的改變:基于 RNA-seq 數據,我們探索了選定基因在已識別途徑中的表達,可以解釋 aldh2.1-/- 斑馬魚與視網膜血管生成增加和葡萄糖穩態受損相關的潛在機制。血管生成標志物的基因表達,如 fgfr2、vegfr2 和 notch1a 在 aldh2.1-/- 和 aldh2.1+/+ 仔魚之間沒有變化。因此,焦點隨后轉移到 MAPK 家族的成員上,因為 ERK1、JNK 和 p38 MAPK 都以其改變內皮細胞活化和血管生成的能力而聞名。mapk3和mapk7(分別稱為ERK1和ERK5)沒有改變。然而,mapk8b(也稱為JNK1)的表達增加了兩倍,而mapk11-14(稱為p38 MAPK)的表達減少了兩倍。同時,通過選定的基因調節糖酵解、糖異生和葡萄糖內化,我們探討了成魚 aldh2.1-/- 突變體餐后血糖濃度降低的原因。RT-qPCR檢測到葡萄糖-6-磷酸酶表達降低了四倍,在糖異生過程中,葡萄糖-6-磷酸轉化為葡萄糖。一份研究確實在幾年前假設 AA 抑制了葡萄糖 6-磷酸酶的表達,我們的數據現在首次在體內顯示了這種調節,因為 aldh2.1-/- 突變體中的 AA 高度增加。相應地,在 aldh2.1-/- 突變體中觀察到葡萄糖激酶 (gck) 減少了三倍,該酶通過葡萄糖磷酸化為葡萄糖 6-磷酸來介導糖酵解的第一步。此外,糖異生的關鍵調節因子磷酸烯醇丙酮酸脫羧酶(pepck)表達下調1.7倍,受底物葡萄糖-6-磷酸刺激的葡萄糖-6-磷酸脫氫酶(g6pd)也下調1.3倍。最后,aldh2.1-/- 突變仔魚中的胰島素表達和 pdx 1 表達顯著下調。總之,選定的單基因表達數據證實了 RNA-seq 數據,它們可以通過斑馬魚仔魚中改變的 JNK 和 p38 MAPK 信號傳導來解釋 aldh2.1-/- 突變體視網膜血管中血管生成的增加。該數據還表明了一種新的葡萄糖代謝受損機制,其中抑制葡萄糖激酶和葡萄糖-6-磷酸酶表達的內源性 AA 的增加會導致低血糖癥。

圖 6. aldh2.1-/- 突變體中葡萄糖-6-磷酸酶/葡萄糖激酶表達的抑制和 JNK 和 p38 MAPK 表達的改變。
外源性AA引起玻璃體血管系統的血管生成性改變、糖代謝受損和MAPK信號改變:對 aldh2.1-/- 突變體的分析確定了視網膜血管中的微血管并發癥,但尚不清楚這些改變是由 aldh2.1-/- 突變體直接誘導還是由內源性 AA 增加并隨后損害葡萄糖代謝和應激信號傳導間接誘導。為了解決這個問題,我們用AA孵育野生型斑馬魚仔魚,并重復之前對視網膜玻璃體結構和RT-qPCR的分析,以確定選定的基因表達。事先對斑馬魚仔魚中的AA進行了毒性測試,結果顯示其 AA耐受性高達500?μM。對 120 hpf 斑馬魚與 50μMA AA 孵育的玻璃體血管分析表明,外源性 AA 可以模擬 aldh2.1-/- 突變體中所見的微血管并發癥,但不會放大它。在有和沒有 AA 孵育的 aldh2.1+/+ 斑馬魚仔魚之間,分支點增加了 1.36 倍。沒有外源乙醛的 aldh2.1+/+ 和有和沒有 AA 孵育的 aldh2.1-/- 斑馬魚仔魚之間的分支點也增加了 1.3-1.5 倍。除視網膜分析外,還對AA孵化的野生型斑馬魚仔魚進行了RT-qPCR。結果顯示 JNK1 表達上調 1.53 倍,p38α MAPK 表達下調 1.77 倍。 此外,ERK1 的表達也略有增加。有趣的是,在 AA 治療后,g6pc 和 gck 表達下降了 2.18 和 1.84 倍,而 pepck 沒有顯著下降。總之,數據表明 aldh2.1-/- 突變體中葡萄糖代謝受損是由 AA 引起的。 由于 aldh2.1 的丟失,AA 未被解毒并在體內積累,并下調 gck 和 g6pc。此外,AA 也被確定為 aldh2.1-/- 視網膜脈管系統中血管生成增加的驅動因素。

圖 7. 外源性 AA 引起玻璃體脈管系統的血管生成改變、葡萄糖代謝受損和 MAPK 信號改變。
p38 MAPK的抑制在aldh2.1+/+ 斑馬魚仔魚的玻璃體血管系統中引起類似但不完全相同的血管生成改變:用選擇性p38 MAPK抑制劑4-(4-氟苯基)-2-(4-甲基亞磺酰基苯基)-5-(4-吡啶基)1H咪唑孵育斑馬魚仔魚來證明是否p38 MAPK 是 AA 水平增加、aldh2.1 敲除和微血管并發癥之間的聯系環節。用 p38 MAPK 抑制劑孵育 aldh2.1+/+ 和 aldh2.1-/- 斑馬魚仔魚來對透明血管進行分析,結果顯示出與先前對 aldh2.1-/- 突變體和用 AA 處理的仔魚相似的結果。aldh2.1+/+ 斑馬魚玻璃體血管在用 p38 MAPK 抑制劑處理后分支點增加了 1.34 倍。 aldh2.1-/- 突變體的處理不能進一步增加分支點。這與之前的 RT-qPCR 結果一致,因為 p38 MAPK mRNA 表達在 aldh2.1-/- 突變體中顯著下調。與 aldh2.1+/+ 仔魚相比,與 p38 MAPK 抑制劑孵育僅導致 aldh2.1-/- 敲除仔魚中玻璃體血管分支點的非顯著增加,因此表明 p38 MAPK 不是這種表型的唯一驅動力。

圖 8. p38 MAPK 的抑制導致 aldh2.1+/+ 仔魚玻璃體血管系統的血管生成改變。
討論:在這項研究中,我們建立了一個 aldh2.1-/- 突變斑馬魚模型來研究 RCS 解毒和體內積累內源性 AA 的后果。AA增加導致視網膜血管微血管損傷,并通過阻斷gck和g6pc基因表達導致餐后血糖水平降低。因此,該研究確定了RCS在不涉及高血糖的情況下損害糖代謝和誘導血管生成的新機制。RCS是在新陳代謝過程中自發形成的,被認為是危險分子,因為它們可以修飾和損害DNA、蛋白質和脂質的功能。近年來,研究表明,特定 RCS 解毒酶的喪失首先導致 RCS 增加,隨后改變了葡萄糖代謝并介導了糖尿病器官并發癥的發展。具體而言,斑馬魚中 glo1 的丟失增加了 MG 濃度,并伴有葡萄糖耐量受損。在 aldh3a1 敲除斑馬魚突變體中,4-HNE 濃度的增加破壞了胰腺的形成,抑制了胰島素的表達,從而促進了高血糖和視網膜血管舒張表型。此外,akr1a1a 斑馬魚突變體中 ACR 的增加導致胰島素抵抗,從而導致糖尿病視網膜病變和糖尿病腎病。本研究中表明 aldh2.1-/- 突變斑馬魚中 AA 濃度的增加會損害葡萄糖代謝,導致血糖水平降低并誘導血管生成的激活。已經確定了個體 RCS 的特定特征及其相應的解毒酶系統。除 AA 外,所有累積的 RCS 都會引起高血糖,從而導致糖尿病視網膜病變或糖尿病腎病的特征。 AA 還誘導視網膜微血管改變,但與高血糖無關。隨后進一步的實驗發現,AA 通過阻斷糖酵解和糖異生的關鍵調節酶(即 gck 和 g6pc)的表達導致葡萄糖敏感性和葡萄糖動員受損,最終導致 aldh2.1-/- 突變體中的餐后血糖濃度降低。aldh2.1 的人類同源物 aldh2,因其在乙醇解毒中的重要性而被廣泛研究。 然而,對酒精介導的應激并發癥的研究主要包括心臟病、癌癥和肝病的研究卻很少。在糖尿病患者中進行的觀察已經將飲酒與低血糖發作聯系起來,但關于酒精如何抑制糖酵解和糖異生的潛在機制尚未探索。導致這種現象的重要上游因素不是乙醇,而是AA。AA阻斷g6pc的表達并隨后抑制葡萄糖-6-磷酸形成葡萄糖并將其釋放到血液中,這一發現在幾年前就已被假設。此外,AA 還通過阻斷 gck 的表達來誘導葡萄糖敏感性降低。 后者本身已知會導致糖尿病或低血糖癥。本研究表明 aldh2 和 AA 在調節葡萄糖代謝中具有高度相關性。該研究還表明,aldh2.1-/- 突變體中內源性 AA 的增加導致視網膜病變而非高血糖。 已知 Aldh2 在保護線粒體方面具有重要功能,特別是 aldh2 的缺失會通過 CYP2E1、Nrf2 和 TNF-α 以及隨后的 RCS 觸發 ROS 形成的增加。此外,改變的 Aldh2 和相應的 AA 與心血管疾病相關,包括但不限于缺血和心肌功能障礙。然而,尚未描述沒有高血糖癥的 aldh2.1-/- 斑馬魚中發生視網膜病變的機制。試驗顯示 aldh2.1-/- 斑馬魚中 JNK 和 p38 MAPK 表達失衡。眾所周知,這兩種應激激活蛋白激酶在血管生成中具有多種功能。 一方面,它們通過激活內皮細胞充當血管生成的分子開關; 此外,它們可以誘導內皮細胞層的高滲透性。此外,血管壁細胞脫落長期以來一直被認為是微血管穩態的關鍵因素,最近的研究表明,壁細胞的丟失增加了視網膜脈管系統對 VEGF 信號傳導和視網膜血管生成的敏感性。因此,aldh2.1-/- 幼蟲和成蟲中視網膜病變的發作是由 MAPK 家族成員的調節改變和通過反應性代謝物 AA 減少血管壁細胞覆蓋率驅動的,與高血糖無關。這項研究和之前的數據表明,內部產生的 RCS 在新陳代謝中會導致糖代謝受損、糖尿病和糖尿病相關的器官并發癥。數據表明,只要 RCS 相應的酶系統功能正常,就可以預防糖尿病和微血管器官的改變。迫切需要確定解毒酶系統的上游因素,了解它們的激活機制以及它們在不同疾病條件下是如何改變的。必須確定RCS及其相應酶系統在糖尿病和其他疾病中的相互作用和串擾。最后,更需解決一個問題,即患病斑馬魚中已識別的RCS改變特征是否也存在于人類疾病中。必須研究RCS是否可以用作不同糖尿病亞型的生物標記物,以及是否會在人類中引發與斑馬魚相同的糖尿病并發癥。
原文出自:Accumulation of acetaldehyde in aldh2.1?/? zebrafish causes increased retinal angiogenesis and impaired glucose metabolism - ScienceDirect




 17312606166
17312606166