近日,華東理工大學藥學院教授趙玉政團隊和上海交通大學醫學院研究員鄭俊克團隊合作,在《細胞生物學趨勢》上發表綜述文章,對氧化還原代謝調控白血病發生發展的病理機制以及目前存在的關鍵問題進行了全面梳理、總結和展望。
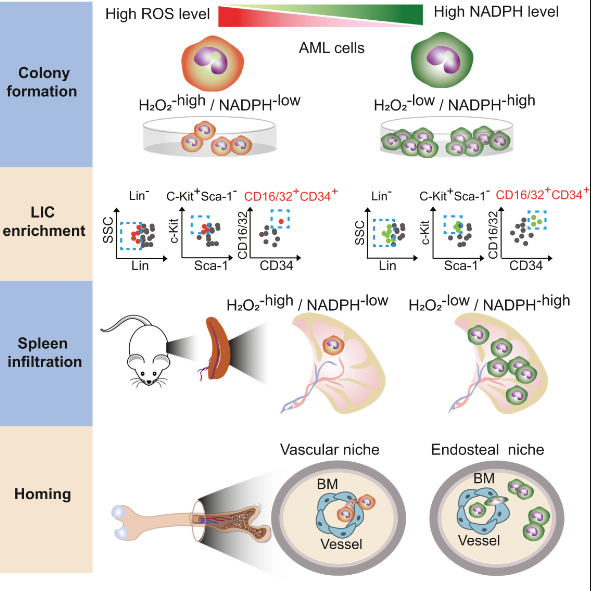
低活性氧和高還原力促進急性白血病發生發展。華理工供圖
氧化還原代謝是一類重要的生化反應,它既驅動能量和物質代謝,也決定了細胞的氧化還原狀態,對細胞的存活、增殖、分化等至關重要。氧化還原代謝在白血病的發生發展中發揮了重要作用,相比于實體瘤,白血病細胞先天具有在循環-免疫系統中遷移和生存的能力,從而增強了它們對氧化應激和轉移過程中失巢凋亡的抵抗。同時,白血病細胞還演化出顯著的代謝異質性,以應對骨髓、血液或脾臟組織不同的營養和氧氣供給等條件帶來的挑戰。為了深入研究白血病的氧化還原代謝調控機制,急需創新發展適用于單細胞、在體的代謝監測技術。遺傳編碼熒光探針可時空分辨地進行代謝監測,是解決這一挑戰的理想工具。研究團隊在過去十余年開發了系列高性能細胞代謝熒光探針以及活細胞代謝監測技術,并應用這一前沿技術系統深入研究了氧化還原代謝的白血病致病機制。
低水平的活性氧對于白血病起始細胞存活和維持靜息狀態至關重要。利用自主研發的過氧化氫探針,研究團隊證明了低活性氧和高還原力細胞亞群富含更多功能性的急性髓系白血病起始細胞,這些細胞傾向于定位在骨內膜微環境里,移植后白血病發病更快,總生存時間更短。蘋果酸酶以及亞甲基四氫葉酸脫氫酶對于這群細胞的白血病形成能力至關重要。除了急性髓系白血病,低的活性氧和高的還原力也與急性或慢性淋巴細胞白血病的發生發展密切相關。
白血病細胞顯示出能量和物質代謝的異質性。一般來說,氧化磷酸化對能量產生至關重要,在許多情況下是通過丙酮酸、脂肪酸、谷氨酰胺和支鏈氨基酸提供燃料。在急性髓系和淋巴細胞白血病中,抑制線粒體呼吸可解除對化療藥物如阿糖胞苷的抵抗,其中,丙酮酸脫氫酶等是潛在的治療靶標。除了氧化磷酸化,高的糖酵解活性也支持白血病發生發展。對于脂肪酸代謝,無論分解還是合成途徑都會驅動白血病的發生。此外,氨基酸和異檸檬酸代謝異常通過改變核苷酸與脂肪酸合成、表觀遺傳修飾等機制起到了促進白血病發生的作用。這些代謝途徑具有密切的聯系,在白血病中,抑制葡萄糖氧化通常會代償性地增加脂肪酸氧化,反之亦然。在葡萄糖/丙酮酸和脂肪酸之間選擇底物不僅決定了能量生產的效率,而且還決定了活性氧的水平。
盡管關于白血病的代謝重編程的研究已經取得了重要進展,但由于細胞代謝、遺傳變異、骨髓微環境的相互影響,致病機制展示出高度的復雜性,白血病的基礎和轉化研究仍然面臨一些尚未解決的重要問題。




 17312606166
17312606166